Cicatrisation cutanée, phases de granulation et maturation
Phase de prolifération et granulation
La troisième phase de cicatrisation consiste à remplacer la matrice de fibrine provisoire par le tissu de granulation. Elle se déroule en plusieurs étapes:
- la réépithélialisation,
- la fibroplasie,
- le dépôt de collagène
- et l’angiogenèse.
Réépithélialisation
La réépithélialisation commence en parallèle de l’inflammation et se caractérise par la prolifération des cellules souches épithéliales dérivées des kératinocytes et leur migration vers les bords de la plaie [Test : NHEK-0033]. Les cellules épithéliales issues des annexes dermiques subissent une transition épithélio-mésenchymateuse qui leur confère des propriétés de motilité. Ces cellules se différencient ensuite en kératinocytes, exprimant des kératines et d’autres marqueurs spécifiques tels que la filaggrine, la loricrine et les transglutaminases [Tests : NHEK-0061 ; NHEK-0062 ; EPIBA-0021 ; EPIBA-0022].
Après avoir atteint le mésenchyme de la MEC, les kératinocytes adhèrent aux berges de la plaie et commencent installation d’une nouvelle membrane basale. Cette fine couche de cellules épithéliales, qui ferme la plaie et la protège des infections et du desséchement, constitue la cicatrice primaire. Ce processus est entre autres régulé par des microARNs (par exemple le miR-213), des facteurs de croissance (EGF, FGFs, TGF-β) et des interleukines, qui permettent l’activation de l’épithélialisation. Le réseau neuronal semble également jouer un rôle important puisque des expérimentations in vitro et in vivo ont montré que les neurones sensoriels accélèrent la fermeture de la plaie en sécrétant des neuropeptides, tels que la substance P et le CGRP.
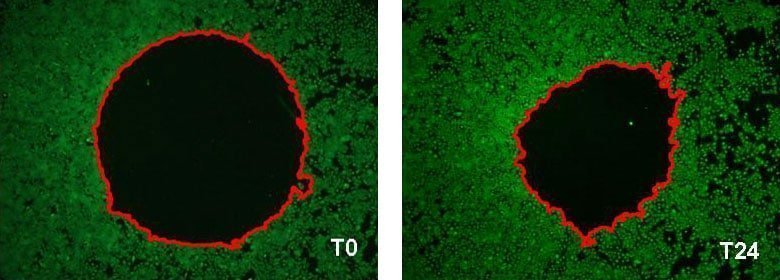
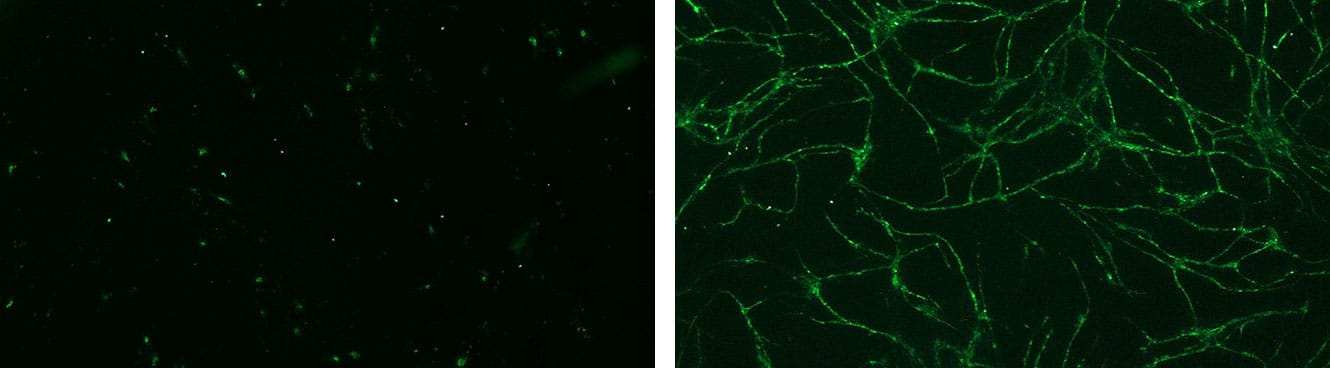
Migration cellulaire de kératinocytes épidermiques humains normaux,
exemple de mesure de surface de recouvrement (zone délimitée en rouge) à T0 et après 24 heures d’incubation. [Test : NHEK-0033]
Fibroplasie et granulation
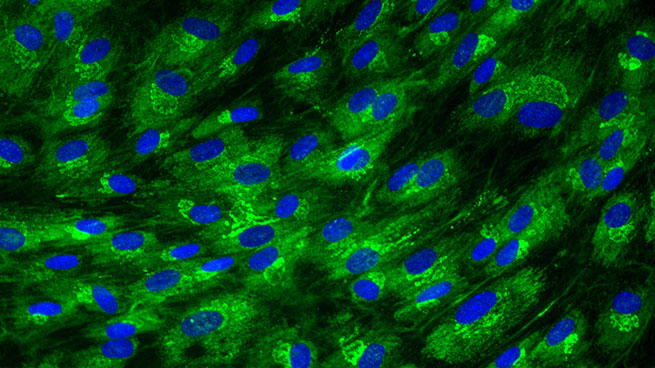
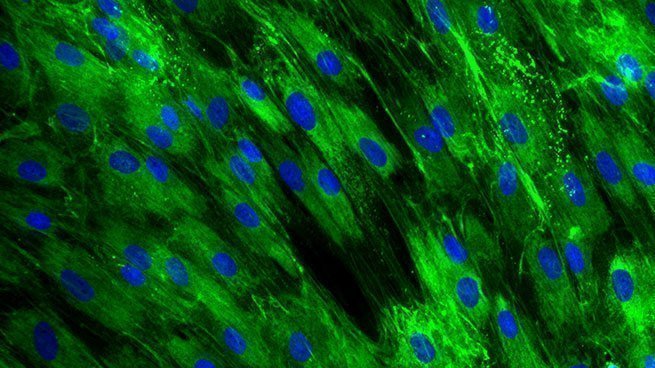
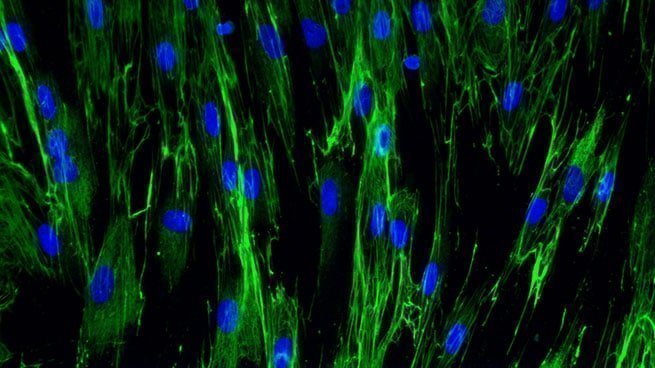
Sous cette nouvelle couche de cellules basales, la fibroplasie est initiée en réponse au FGF, TGF-β1 and PDGF [Tests : NHDF-0003; NHDF-0004]. Cette étape consiste en la différenciation, la prolifération et la migration des fibroblastes dans la plaie pour former le tissu de granulation. Les fibroblastes, issus des cellules souches du derme, synthétisent de nouveaux composants de la MEC, à savoir les collagènes de type I et III, les glycosaminoglycanes, les protéoglycanes, l’acide hyaluronique et la fibronectine [Tests : NHDF-0008 ; NHDF-0009 ; NHDF-0026 ; NHDF-0028 ; NHDF-0030 ; SKIBA-0017]. De façon concomitante, la sécrétion des MMPs diminue et la production de leurs inhibiteurs TIMPs (Tissue Inhibitors of Matrix Metalloproteases) est activée afin d’augmenter la résistance du tissu de granulation.
Expression de collagène I dans des fibroblastes dermiques
[Test : NHDF-0026]
Expression de collagène III dans des fibroblastes dermiques
[Test : NHDF-0028]
Expression de fibronectine dans des fibroblastes dermiques
[Test : NHDF-0030]
Angiogenèse
En parallèle de la fibroplasie, l’angiogenèse induite par l’hypoxie du tissu, permet la restauration de la perfusion vasculaire par la formation de nouveaux vaisseaux sanguins. Les facteurs proangiogéniques (FGF, PDGF et VEGF) et les cytokines produites par les plaquettes stimulent la migration, la prolifération et la maturation des cellules endothéliales résidentes [Test : ENDOF-0001]. Les cellules progénitrices endothéliales dérivées de la moelle osseuse participent également à la néovascularisation au site de lésion. Le facteur LL-37 sécrété durant la phase inflammatoire semble être impliqué dans l’activation de ces cellules endothéliales.
Myofibroblastes
A la fin de cette phase, les fibroblastes se différencient en myofibroblastes, qui acquièrent des propriétés contractiles suite à l’expression d’actine alpha dans les faisceaux de microfilaments et les fibres de stress, en réponse au TGF-β, à la tension tissulaire et aux protéines de la matrice (fibronectine et ténascine C). Les forces contractiles de l’actine sont transmises à la MEC via les complexes d’adhésion focale impliquant les intégrines, récepteurs assurant les interactions cellule-MEC. Ainsi les myofibroblastes jouent un rôle essentiel dans la contraction de la plaie, la fermeture des bords et la maturation du tissu de granulation [Tests : NHDF-0035 ; DE-0001; NHDF-0051].
Formation de pseudotubes dans des cellules endothéliales microvasculaires dermiques en absence (gauche) ou en présence (droite) de VEGF
[Tests : ENDOF-0001 et ENDOF-0002]
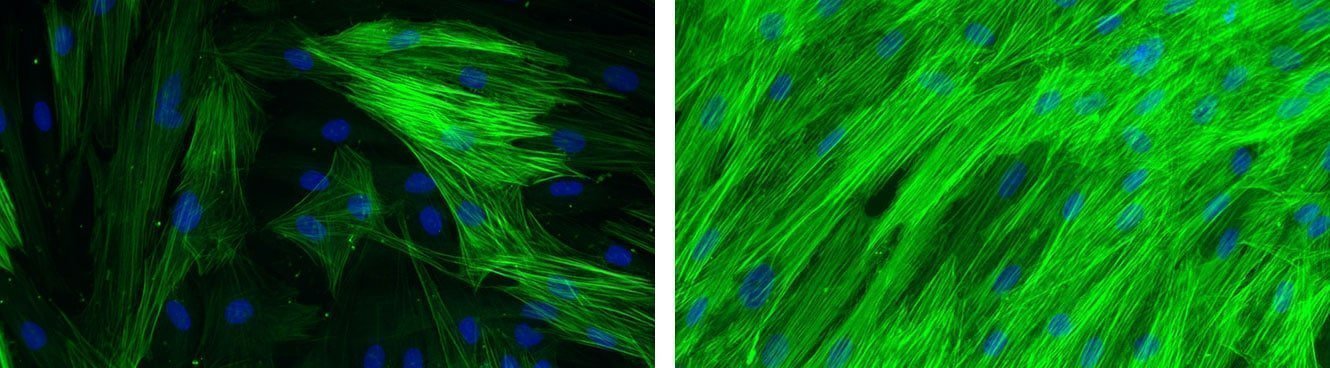
Expression d’alpha-SMA dans des fibroblastes dermiques en absence (gauche) ou en présence (droite) de TGF-β
[Tests : NHDF-0035 et NHDF-0051]
Phase de remodelage et maturation
Durant cette dernière phase de la réparation cutanée, la plaie subit un remodelage constant et progressif qui peut durer plusieurs années. Cette étape, essentielle pour la restauration de la fonctionnalité du tissu, fait intervenir les MMPs et les TIMPs pour la synthèse et la maturation de la MEC. Le diamètre des faisceaux de collagène augmente et l’acide hyaluronique ainsi que la fibronectine sont peu à peu dégradés. Le collagène de type III, présent majoritairement dans le tissu de granulation, est progressivement remplacé par celui de type I, composant principal du derme [Tests : NHDF-0026 ; NHDF-0011].
Ce nouveau collagène est plus orienté et organisé en maillage structuré, composé de glycosaminoglycanes et de protéoglycanes. L’élastine, absente du tissu de granulation, est resynthétisée, contribuant ainsi à l’élasticité de la peau [Test : NHDF-0075]. La résistance maximale de la cicatrice définitive n’atteint cependant que 80% de celle de la peau d’origine. La cicatrice présente un aspect lisse et mat avec une pigmentation souvent plus claire due à une absence de mélanine. La repigmentation dépend de la profondeur et de la largeur initiales de la plaie, ainsi que de la présence des follicules pileux contenant les cellules souches mélanocytaires. En outre, la différenciation des mélanocytes et la mélanogenèse sont souvent perturbées au cours de la cicatrisation [Test : NHEM-0001]. Cette absence de pigmentation prive la cicatrice de protection contre les rayons UVs, la rendant plus sensible au soleil.
Dans la dernière phase de résolution, le nombre de cellules est considérablement diminué du fait de l’apoptose des cellules vasculaires, des macrophages et des myofibroblastes. La densité vasculaire retrouve également son niveau normal, par la régression des capillaires nouvellement formés. Enfin la sensibilité de la peau est restaurée grâce à la formation d’un nouveau réseau de neurones sensoriels [Test : NS-0001].
Pour conclure
La régénération de la peau suite à une lésion est le résultat d’interactions complexes entre les cellules souches, les cellules différenciées, les composants de la MEC (matrice et protéines matricellulaires) et les forces mécaniques de la peau. La prolongation ou la dérégulation d’une des phases de la réparation cutanée peut être à l’origine d’une cicatrisation pathologique conduisant à des cicatrices hypertrophiques ou kéloïdes, ou à des cicatrices chroniques. Élucider et comprendre les mécanismes cellulaires et moléculaires impliqués dans la cicatrisation normale et pathologique est d’un intérêt primordial pour développer de nouveaux biomarqueurs permettant de prédire les complications de cicatrisation et concevoir de nouvelles stratégies pour les prévenir et les traiter (méthodes de chirurgie, thérapies pharmacologiques ou produits de la bioingénierie). Par exemple, l’utilisation de cellules souches (épithéliales, dermales, mélanocytaires et/ou adipocitaires) dans des thérapies cellulaires régénératives pourrait constituer une nouvelle perspective, puisqu’elles participent à toutes les étapes de la réparation cutanée.